Gdy sprężamy gaz w jakimś zamkniętym naczyniu – na przykład w tłoku, to rozumiem, że gdy zrobimy to powoli będziemy mieć przemianę izotermiczną, a gdy szybko adiabatyczną. Pytanie jednak dlaczego nie może być to przemiana izobaryczna (gdy robimy to powoli) ? W takiej przemianie zmniejszamy objętość, więc powinna zmaleć temperatura – oddajemy energię układu na rzecz zachowania ciśnienia. Co „przeszkadza” gazowi by „wybrać” tę przemianę, a nie izotermiczną? Jaki jest przykład w takim razie przemiany izobarycznej?
Jaki są przykłady przemiany izobarycznej oraz izotermicznej?
Pytanie
Odpowiedź
O tym z jakim typem procesu termodynamicznego mamy do czynienia decydują te warunki zewnętrzne, które pozostają niezmienne podczas przemiany gazu. Aby lepiej zrozumieć tę zasadę rozpatrzmy gaz w cylindrycznym naczyniu jak na rysunku poniżej.
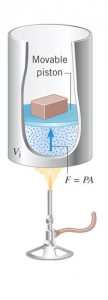 Naczynie jest od góry zamknięte ruchomym tłokiem obciążonym masą $M$. Jego ścianki dobrze izolują gaz od otoczenia, natomiast jego dolna powierzchnia jest wykonana z materiału dobrze przewodzącego ciepło. Całość jest ustawiona na palniku o regulowanym strumieniu ognia, który wyznacza temperaturę otoczenia dla gazu.
Naczynie jest od góry zamknięte ruchomym tłokiem obciążonym masą $M$. Jego ścianki dobrze izolują gaz od otoczenia, natomiast jego dolna powierzchnia jest wykonana z materiału dobrze przewodzącego ciepło. Całość jest ustawiona na palniku o regulowanym strumieniu ognia, który wyznacza temperaturę otoczenia dla gazu.
Niech na początku gaz będzie w stanie równowagi, czyli z jego definicji, temperatura gazu będzie równa temperaturze otoczenia $T$, gdyż tylko wtedy nie będzie następował przepływ strumienia ciepła, a jego ciśnienie $p$ będzie koniecznie takie, aby zrównoważyć ciężar tłoka. Teraz zmniejszajmy bardzo powoli masę obciążenia tłoka. Można to zrobić dzieląc masę $M$ na wiele bardzo małych odważników i powoli zdejmując je jeden po drugim. Na skutek tego procesu po dojściu do nowego stanu równowagi ciśnienie gazu będzie mniejsze, gdyż musi zrównoważyć mniejszy ciężar tłoka. Zatem nie jest to przemiana izobaryczna. Natomiast temperatura się nie zmieni, ponieważ nie zmieniliśmy warunku zewnętrznego jakim jest tutaj strumień ognia i tym samym temperatura otoczenia. Jest to zatem przykład przemiany izotermicznej.
Następnie, zwiększajmy bardzo powoli strumień ognia co prowadzi do powolnego wzrostu temperatury otoczenia. Jednocześnie nie zmieniamy masy tłoka podczas przemiany. W nowy stanie równowagi tym razem zmieni się temperatura gazu, więc nie jest to przemiana izotermiczna. Natomiast jego ciśnienie pozostanie bez zmian, gdyż nie zmieniliśmy warunku zewnętrznego jakim jest tutaj ciężar tłoka, który determinuje równowagowe ciśnienie gazu. Jest to zatem przykład przemiany izobarycznej.
Jako że oba procesy następowały bardzo powoli, to w ich czasie gaz przechodził przez kolejne stany równowagi i tym samym były to przemiany odwracalne odpowiednich typów.

